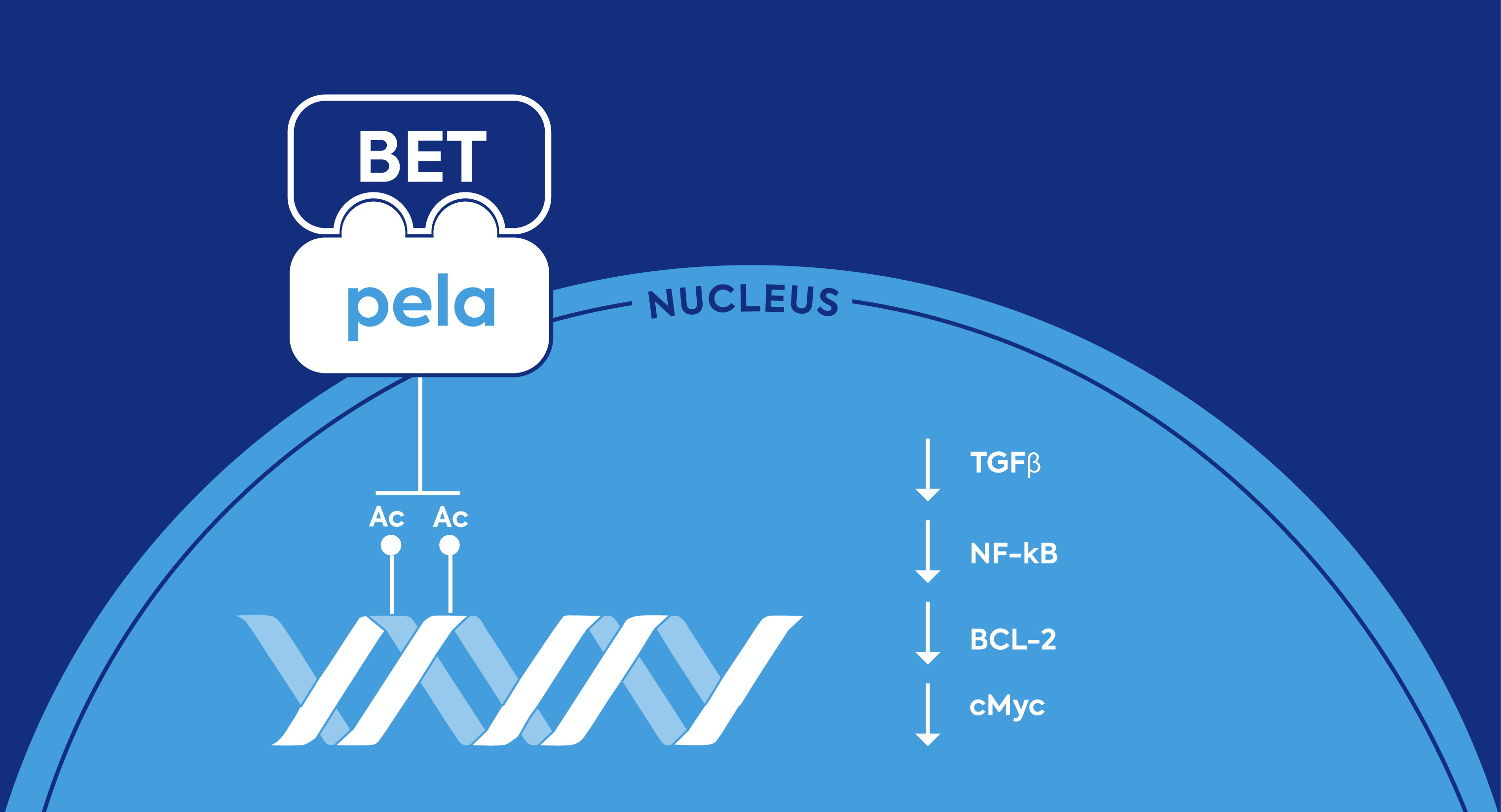
Pelabresib ist ein selektiver niedermolekularer Wirkstoff in der Entwicklungsphase, der durch die Hemmung der Funktion von BET-Proteinen (BET - Bromodomain- und Extra-Terminal-Domain) die Anti-Tumor-Aktivität fördern soll, indem er Gene, die bei Blutkrebs eine Rolle spielen können, herunterreguliert.
Pelabresib hemmt die Funktion der BET-Proteine
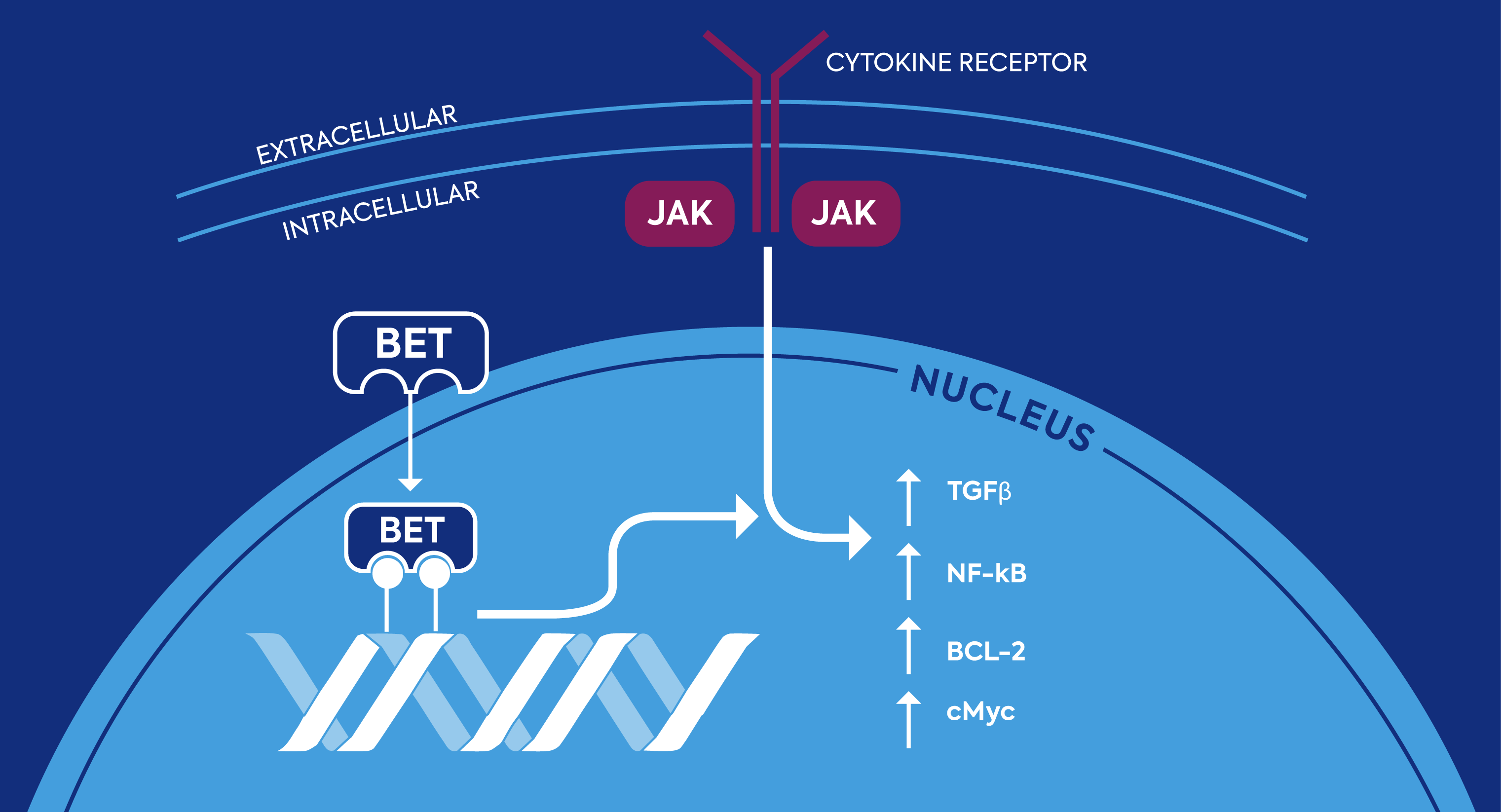
Die Familie der BET-Proteine und der JAK-STAT-Signalweg sollen mit der Entstehung und dem Fortschreiten von Myelofibrose in Zusammenhang stehen. Beide Signalwege können die Menge an entzündungsfördernden Zytokinen erhöhen und die unkontrollierte Produktion von blutbildenden Zellen anregen, den so genannten Megakaryozyten. Die Familie der BET-Proteine gilt daher als vielversprechendes therapeutisches Ziel, dessen Modulation die der Myelofibrose zugrunde liegende Krankheitsursache verändern könnte, wobei gemeinsam mit der JAK-Hemmung weitere Synergieeffekte möglich wären.
Der JAK-STAT-Signalweg und BET-Proteine sollen an der Entstehung von Myelofibrose beteiligt sein
Pelabresib wird derzeit bei Patientinnen und Patienten untersucht, die Myelofibrose haben und zuvor nicht mit einem JAK-Inhibitor behandelt wurden (JAK-Inhibitor-naiven Patienten) In der Phase 3 MANIFEST-2 Studie und im Arm 3 der Phase 2 MANIFEST-Studie wird die Kombination aus Pelabresib und dem JAK-Inhibitor Ruxolitinib verglichen mit der Behandlung mit Placebo und Ruxolitinib. Eine vollständige Liste der MANIFEST-Studienarme befindet sich weiter unten.
Zusätzlich zu den Myelofibrose-Studien, konnten frühe Studien mit Pelabresib erste Hinweise auf klinische Wirksamkeit in anderen myeloiden Erkrankungen geben. Wir sind gespannt, Pelabresib im Niedrigrisiko-Myelodysplastischen Syndrom (MDS) und der essenziellen Thrombozythämie weiter zu erforschen.
Die Entwicklung von Pelabresib wurde zum Teil von der Leukemia and Lymphoma Society® unterstützt.

