MorphoSys’ HuCAL- und Ylanthia-Technologien sowie die Protein-Engineering-Fähigkeiten bilden die Grundlage für unsere bi- und multispezifische Antikörperplattformen der nächsten Generation.
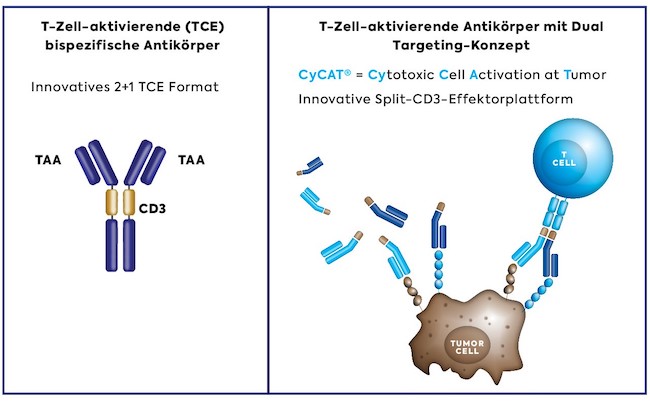
Bispezifische Antikörper (BsAbs) sind Proteine, die so entwickelt wurden, dass sie zwei verschiedene Ziele gleichzeitig erkennen. Solche Proteine mit "Zwei-Ziel"-Funktionalität können mit mehreren Oberflächenrezeptoren oder Rezeptorliganden interferieren. BsAbs können auch Targets in unmittelbarer Nähe platzieren, entweder um die Bildung von Proteinkomplexen auf einer Zelle zu unterstützen oder um Kontakte zwischen Zellen auszulösen. Die häufigste Art von BsAbs in der Entwicklung sind so genannte T-Zell-aktivierende (TCE) bispezifische Antikörper, die die Signalgebung des CD3-Oberflächenrezeptors auf T-Zellen auslösen und außerdem an ein zweites Zielprotein auf Tumorzellen binden, wodurch zytotoxische T-Zellen gezielt aktiviert werden, um Krebszellen mit einem Antikörpermolekül abzutöten. Diese Behandlungen machen etwa 45 % der Pipeline an bispezifischen Antikörpern aus und könnten die nächste Generation neuartiger antikörperbasierter Therapien werden, die das Potenzial haben, das derzeitige Behandlungsschema in der Onkologie grundlegend zu verändern.
Im November 2020 gaben MorphoSys und Cherry Biolabs, ein Spin-off des Universitätsklinikums Würzburg, eine Lizenzvereinbarung bekannt, die MorphoSys die Rechte zur Nutzung der innovativen, multispezifischen Hemibody-Technologie von Cherry Biolabs für sechs exklusive Zielmoleküle einräumt. In Kombination mit unserer Antikörper-Expertise und -Technologie bietet die Hemibody-Technologie die Möglichkeit, neuartige, T-Zell-aktivierende (TCE) Medikamente mit höherer Präzision und besserem Verträglichkeitsprofil für die Behandlung von Krebspatienten zu entwickeln. Wir beabsichtigen, die Hemibody-Technologie im Rahmen unseres CyCAT® Dual-Targeting-Konzepts einzusetzen, um neuartige Hemibody-basierende Behandlungsoptionen für Patienten mit hämatologischen und soliden Krebserkrankungen zu erforschen und voranzutreiben.